Реферат На Тему Кристалічні Гратки
Кристалічні ґратки. Атомні, молекулярні та йонні кристали. Залежність фiзичних властивостей речовин від типів кристалічних ґраток Тобі вже відомі такі частинки, як,. Це відносно проста форма організації речовини.
Дефекти кристалічної гратки. Реферат: This paper reports the results of structural, photoluminescence and Raman characterization of thick Cd1−xZnxTe. На тему: Хищение чужого имущества совершенного путем грабежа. Готовых материалов при сдаче контрольных, рефератов, лабораторных,.
У стандартних умовах ці частинки, як правило, індивідуально не існують. За допомогою різних типів хімічних зв'язків вони об'єднуються й утворюють вищу форму організації речовини — хімічні сполуки, що поділяються на прості і складні речовини, які існують у твердому, рідкому та газуватому стані.
Якщо гази характеризуються повною невпорядкованістю розташування молекул одна відносно одної, то в рідинах деяка впорядкованість частинок спостерігається. Адже для рідин характерна наявність певного об'єму, хоча й відсутня певна форма. Займають проміжне місце між газами і твердими тілами, яким властивий суворий порядок розташування частинок, що утворюють речовину.
У частинки розташовані у просторі суворо закономірно для кожної речовини. Щоб якось уявити цю закономірність, у тривимірному просторі подумки об'єднай центри молекул прямими лініями, які перетинаються. При цьому утвориться просторовий каркас, який називають кристалічними ґратками. Місця, в яких лінії перетинаються, називають вузлами кристалічних ґраток. Залежно від природи частинок, що містяться у вузлах кристалічних ґраток, розрізняють йонні, атомні, молекулярні кристалічні ґратки.
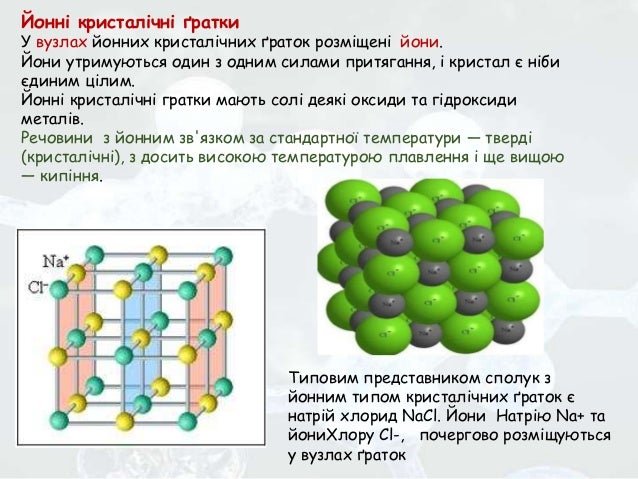
Металічні кристалічні ґратки, їх вивчатимеш пізніше (мал. Йонні кристалічні ґратки. Типовим представником сполук з йонним типом кристалічних ґраток є натрій хлорид NaCl. Його кристалічні ґратки утворені йонами Натрію Na + та йонами Хлору Сl -, які почергово розміщуються у вузлах ґраток (мал. Иони утримуються один з одним силами притягання, і кристал солі є ніби єдиним цілим. Типи кристалічних ґраток: а — атомні; б — йонні; в — металічні; г — молекулярні Мал. Схема зображення йонних кристалічних ґраток натрій хлориду Оскільки в кристалі сили притягання поширюються однаково в усіх напрямках, йони Натрію і Хлору сполучаються дуже міцно, хоча кожний із них не зафіксований нерухомо.
Иони безперервно здійснюють теплові коливання навколо свого положення в ґратках. Міцність йонних кристалів залежить також і від заряду та радіуса йонів. Однак їх поступальний рух уздовж ґраток не відбувається, тому всі речовини з йонним зв'язком за стандартної температури — тверді (кристалічні), з досить високою температурою плавлення і ще вищою — кипіння. Молекул у йонних кристалах немає, є тільки йони. Лише у газуватому стані (пара) натрій хлорид існує у вигляді молекул NaCl. Подібно до натрій хлориду майже всі солі, основні оксиди, гідроксиди складаються не з молекул, а з йонів.
Зверни увагу, хімічні формули йонних сполук передають лише співвідношення позитивно і негативно заряджених йонів у кристалічних ґратках. Йонні сполуки в цілому електронейтральні.
Наприклад, згідно з формулою йонного кристала CaF 2 співвідношення позитивно заряджених йонів Са 2+ і негативно заряджених йонів F - у ґратках дорівнює 1:2. Оскільки кожні два позитивні заряди Са 2+ нейтралізуються двома негативними зарядами 2F -, то речовина CaF 2 — електронейтральна. Хоча реальних молекул у йонних кристалах не існує, для однаковості з ковалентними речовинами прийнято за допомогою формул NaCl, CaF 2 тощо передавати найпростіший склад йонної речовини та характеризувати її також певним значенням відносної молекулярної (формульної) маси на підставі її формульного складу.
А поняття про валентність як певне число ковалентних зв'язків до йонних сполук застосувати неможливо (тому й будемо говорити про ступінь окиснення елементів). У вузлах атомних кристалічних ґраток містяться окремі атоми, сполучені між собою ковалентними зв'язками. Такі кристалічні ґратки має алмаз (мал. У його кристалі кожний атом Карбону сполучений ковалентними зв'язками з чотирма сусідніми атомами Карбону, тобто утворює чотири спільні електронні пари.

Ось чому можна говорити, що Карбон — чотиривалентний елемент.4 +1 +4 -2 Ступінь окиснення Карбону також -4 або +4, залежно від того, з яким елементом він взаємодіє — СН 4, СО 2. Схематичне зображення атомних кристалічних ґраток алмазу Алмаз та інші речовини, які мають атомні кристалічні ґратки, характеризуються великою твердістю, дуже високими температурами плавлення і кипіння, вони практично не розчиняються в жодних розчинниках, не проводять електричний струм, оскільки вільних електронів немає, всі 4 валентні електрони беруть участь в утворенні ковалентних зв'язків. Атомні ґратки мають лише деякі речовини у твердому стані (силіцій Si, бор В, силіцій(IV) оксид SiO 2, силіцій(ІV) карбід SiC та ін.). У вузлах молекулярних кристалічних ґраток містяться молекули як неполярні, так і полярні. Наприклад, у вузлах кристалічних ґраток йоду містяться молекули йоду І 2 (мал. Сили міжмолекулярної взаємодії, так звані сили Ван-дер-Ваальса, значно слабкіші за сили ковалентного зв'язку.
Реферат На Тему Спорт
Тому речовини з молекулярними ґратками мають невелику твердість, вони легкоплавкі і леткі. До таких речовин належать, наприклад, йод, нафтален, бром, вода, спирт, хлор, амоніак NH 3, метан СН 4. Схематичне зображення молекулярних кристалічних ґраток йоду Отже, будова речовини та її властивості пов'язані. Тому якщо відома будова речовини, можна прогнозувати її властивості, і навпаки, якщо відомі властивості речовини, можна робити висновки про її будову. Зв'язок будови і властивостей речовин показаний в узагальнюючій табл. Тип кристалічних ґраток і властивості речовин Bисновки У кристалічних речовинах атоми, молекули, йони розміщуються в певному порядку, утворюючи кристалічні ґратки.

Розрізняють атомні, молекулярні, йонні та металічні кристалічні ґратки. Між будовою речовини, яка визначається типом хімічного зв'язку і типом кристалічних ґраток, та її властивостями існує певна залежність: чим міцніший хімічний зв'язок, що утримує частинки у вузлах кристалічних ґраток, тим міцніші кристали, тим твердіша речовина, тим вищі її температури плавлення і кипіння. Завдання для самоконтролю 1. У чому полягає відмінність йонних, атомних і молекулярних кристалічних ґраток? Як, знаючи фізичні властивості речовини, можна дійти висновку про тип її кристалічних ґраток? Покажи на прикладі. Поясни причину відмінності температури плавлення речовин із різним типом кристалічних ґраток.
За якими ознаками можна віднести до речовин з молекулярними кристалічними ґратками: а) лід; б) нафтален? Молекулярні кристалічні ґратки можуть мати речовини з хімічним зв'язком (а) йонним; (в) ковалентним полярним; (б) металічним; (г) ковалентним неполярним.
Реферат На Тему Древняя Греция
Речовини з молекулярними кристалічними ґратками (а) легкоплавкі; (в) добре проводять електричний струм; (б) леткі; (г) мають низьку теплопровідність. Речовина, що має найвищу температуру плавлення, — це (а) йод; (б) лід; (в) кальцій флуорид. Додаткові завдання 8. Яке передбачення про кристалічні ґратки речовини можна висловити, якщо відомо, що за стандартних умов вона перебуває у газуватому стані, а за температури - 40 °С ця речовина являє собою безбарвні кристали, які не проводять електричний струм? Речовина, хімічні зв'язки в якій сформовані між атомами елементів із зарядами ядер +1 і +16, у твердому стані має кристалічні ґратки (а) йонні; (б) молекулярні; (в) атомні. Речовина, утворена елементами із скороченими електронними конфігураціями атомів.3s 13p 0 і.3s 23p 5, має кристалічні ґратки (а) атомні; (б) йонні; (в) молекулярні.
Кристалічні тіла мають певну температуру плавлення, незмінну при сталому тиску; в’язкість аморфних речовин під час нагрівання зменшується; вони переходять у рідкий стан, розм’якшуючись поступово. Кристали характеризуються наявністю значних сил міжмолекулярної взаємодії і зберігають сталим не лише свій об’єм, а й форму. Правильна геометрична форма є істотною зовнішньою ознакою будь-якого кристала в природних умовах. Розглядаючи окремі кристали, можна переконатися, що вони обмежені плоскими, ніби шліфованими гранями у вигляді правильних багатокутників. Кристали певної речовини можуть мати різну форму, оскільки вона залежить від умов їх утворення. Монокристали і полікристали.
Реферат На Любую Тему
Іноді весь шматок твердої речовини може становити собою один кристал. Такі, наприклад, шматочки цукру, солі, гірського кришталю тощо. Це все окремі кристали, їх називають монокристалами. В інших випадках тіла складаються з безлічі кристалів, які зрослися між собою. Кристалічну будову мають всі метали у твердому стані. Тіло, яке складається з безлічі невпорядковано розміщених дрібних кристалів називають полікристалічним, або полікристалом.